D.M.M. Borducchi, J. Kerbauy, J.S.R. de Oliveira
Disciplina de Hematologia e Hemoterapia da Universidade Federal de São Paulo - Escola Paulista de Medicina, São Paulo, SP.
UNITERMOS: Linfoma de Células T. HTVL-I. L/LTA. Revisão.
KEY WORDS: T-cell lymphoma. HTLV-I. ATL. Review.
INTRODUÇÃO
O Linfoma/Leucemia de Células T do Adulto (L/LTA) foi a primeira neoplasia humana relacionada a retrovírus. Em 1973 foi reconhecida como entidade patológica no Japão1 e, quatro anos depois, internacionalmente2,3. O vírus da leucemia humana de células T (HTLV), primeiro retrovírus humano descrito, foi isolado de linhagem celular de paciente portador de linfoma de células T cutâneo agressivo, posteriormente considerado como L/LTA4.
Em 1979 as células do L/LTA foram cultivadas "in vitro"5 e a seguir utilizou-se esta linhagem celular para detectar os antígenos virais, correlacionando-os com portadores desta neoplasia por técnica de imunofluorescência indireta6. A estrutura do vírus obtida do DNA genômico de linhagens celulares tumorais foi estabelecida por Yoshida em paciente com L/LTA7.
No Brasil, o primeiro estudo de soroprevalência do HTLV foi publicado em 19868, pelo qual os autores identificaram uma população de imigrantes japoneses provenientes de Okinawa com índice de positividade de 13%. O L/LTA foi descrito no Brasil em 19909 e a partir desta data, vários estudos foram realizados na tentativa de se definir o padrão epidemiológico em nosso país.
Os dados clínicos do L/LTA foram estabelecidos por Takatsuki et al., em 1992: esta patologia ocorre em adultos entre 40 e 70 anos de idade, com média de 58 anos em japoneses, e entre 19 e 62 anos, com média de 43 anos no Caribe. Existe predominância de soropositividade no sexo feminino e, paradoxalmente, maior acometimento de doença no sexo masculino, numa razão de 1,4:1. Os sinais clínicos mais encontrados ao exame físico são a adenomegalia (60%), hepatomegalia (26%), esplenomegalia (22%) e lesões de pele (39%). Sintomas de desconforto abdominal, diarréia, cólica, ascite e tosse estão associados com determinados subtipos de L/LTA10.
Quanto aos dados laboratoriais, a hipercalcemia é complicação freqüente e aparece em 28% dos pacientes na ocasião do diagnóstico, e em 50% na evolução clínica, acompanhada de lesões osteolíticas11. Em observações necroscópicas, em que analisaram-se ossos de pacientes com hipercalcemia, notou-se proliferação desordenada de osteoclastos com reabsorção óssea. A infiltração óssea por células do L/LTA foi observada somente em um paciente, indicando que apenas neste caso os osteoclastos poderiam ter sido ativados pelas células tumorais. Deste modo, a hipercalcemia associada ao L/LTA é mediada por fator humoral (fatores humorais da hipercalcemia das neoplasias). Outros fatores como a interleucina 1(IL-1) alfa e IL-1 beta, fator transformador de crescimento beta (TGF-b) e paratormônio estão diretamente implicados à hipercalcemia12,13.
A DHL (desidrogenase lática) encontra-se elevada na maioria dos pacientes e constitui-se em indicador de agressividade desta patologia. Os níveis séricos de cálcio e DHL refletem a extensão da doença e podem ser utilizados como monitores para avaliar sua atividade, correlacionando-se diretamente com o grau de agressividade clínica10.
A hiperbilirrubinemia pode ser observada nos casos de infiltração hepática, indicando pior prognóstico. Hipergamaglobulinemia é de ocorrência rara, e por ser muito freqüente nos linfomas não-Hodgkin de alto grau de malignidade HTLV-I negativo, é utilizada como fator de diagnóstico diferencial entre as duas entidades10.
Dentre outros marcadores de atividade da doença, destacam-se os níveis séricos de b2 microglobulina e de receptor de cadeia a da interleucina-2 (IL-2). O primeiro é expresso conjuntamente com antígenos da classe I de HLA nos linfócitos T e o segundo nos linfócitos T ativados10.
O número de leucócitos geralmente está normal ou aumentado no sangue periférico, onde também são observadas células leucêmicas chamadas "flower cells", identificadas pelo aspecto lobulado do núcleo e cromatina nuclear grosseira, achado que a diferencia do núcleo convoluto do linfoma linfoblástico. A anemia, neutropenia e plaquetopenia são raramente observadas10.
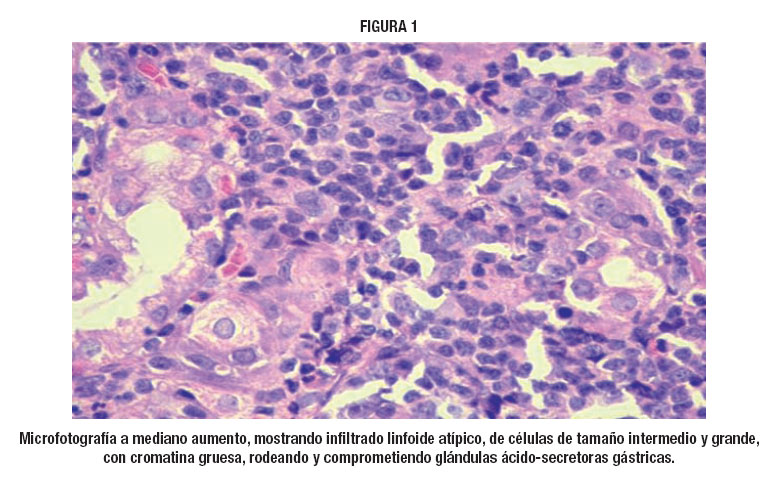
No L/LTA típico, a arquitetura dos linfonodos geralmente encontra-se destruída, apesar do arranjo vascular e espaços peri-vasculares estarem intactos. O centro germinativo e os folículos linfóides desaparecem totalmente em virtude da proliferação celular difusa. Observam-se células grandes com núcleo ovóide e vesicular, nucléolo proeminente, citoplasma amplo e abundante, PAS negativo. Há também, presença de células de tamanho médio com núcleo redondo ou cerebriforme e células pequenas com núcleo irregular, escuro e picnótico. Nota-se também células multinucleadas gigantes, semelhantes às células de Reed-Sternberg, com citoplasma amplo e basofílico. Estas características dão aos linfonodos aspecto pleomórfico14.
Existe proliferação desordenada clonal de linfócitos T "helper" ativados com supressão da atividade normal, e com fenótipo CD3+, CD4+, CD8-, CD25+, CD7-, HLA-DR+. Em alguns casos raros, as células do L/LTA podem expressar CD4 e CD8, somente CD8 ou não expressar CD4 e CD815 .
Estudos citogenéticos mostram que não existem anormalidades estruturais específicas desta patologia; no entanto, elas são freqüentemente detectadas nas formas agressivas16. Foram analisados 107 cariótipos de pacientes com L/LTA, por Kamada et al., que revelaram várias anormalidades cromossômicas: trissomias dos cromossomos 3 (21%), 7 (10%), e 21 (9%), monossomia do cromossomo X (38%) no sexo feminino, e perda do cromossomo Y (17%) em homens. Anormalidades estruturais envolvendo translocações 14q32 (28%) ou 14q11 (14%), e deleções 6q (23%) também foram observadas17.
O tempo de sobrevida para os subtipos agressivos varia de semanas a mais de um ano. Complicações pulmonares, incluindo pneumonia por Pneumocystis carinii, hipercalcemia, herpes zoster disseminado, meningite criptococócica e infecção por citomegalovírus, são as causas mais freqüentes de morte10. Além do L/LTA existem outras doenças diretamente associadas ao HTLV-I, e algumas relacionadas a este vírus18.
Doenças associadas ao HTLV-I (Retrovírus identificado pela técnica da PCR-Polimerase Chain Reaction)18.
Linfoma/Leucemia de Células T do Adulto; Paraparesia Espástica Tropical; Uveíte; Alveolite Linfocítica; Dermatite Infecciosa; Artropatia; Polimiosite; Linfadenopatia.
Doenças Relacionadas ao HTLV-I (Alto percentual de portadores de anticorpos anti- HTLV-I)18
Síndrome de Sjögren; Tireoidite de Hashimoto; Artrite Reumatóide; Sarna Norueguesa; Insuficiência Renal Crônica; Micose Cutânea Inespecífica; Estrongiloidíase; Neoplasia de diversos órgãos; Doenças Oportunistas Pulmonares.
Em 1991 foram estabelecidos critérios diagnósticos que classificam o L/LTA em quatro subtipos clínicos19: 1)Smoldering: caracterizado pela contagem normal de linfócitos (<4x 109/l) e pela presença de 5% ou mais de linfócitos anômalos no sangue periférico, ausência de hipercalcemia, DHL elevada, porém não excedendo cinco vezes o valor normal, não envolvimento do fígado, baço, SNC, ossos ou trato gastro-intestinal. Lesões de pele ou pulmão podem ser observadas, porém nunca derrame pleural ou ascite. 2) Crônico: o número absoluto de linfócitos está aumentado (>4x 109/l), ausência de hipercalcemia, DHL aumentada duas vezes, não envolvimento do SNC, ossos, ou trato gastro-intestinal. Comprometimento do fígado, baço, pele e pulmões e alterações histológicas em linfonodos, com ou sem lesões extranodais. Presença de 5% ou mais de linfócitos anômalos no sangue periférico. 3) Linfoma: neste subtipo não há linfocitose e apenas 1% ou menos dos linfócitos são anômalos. Existe comprometimento de linfonodo com ou sem lesão extranodal. Esta forma em tudo se confunde com LNH de alto grau de malignidade. 4) Agudo: é a forma mais comum de apresentação, onde a doença é muito agressiva e manifesta-se sob a forma leucêmica com lesões tumorais. Pacientes com esta forma muitas vezes apresentam-se com mal-estar-geral e distensão abdominal. O envolvimento da pele é característico, sendo as formas papular e micropapular as manifestações cutâneas mais freqüentes; no entanto, eritemas e nodulações são também observadas. No anátomo-patológico visualiza-se infiltração de espaços perivasculares da epiderme, produzindo muitas vezes a configuração de microabcessos de Pautrier. Alguns pacientes mostram infiltração da pleura e do peritôneo, e outros infiltração do SNC, ossos e medula óssea. A sobrevida varia de duas semanas a mais de um ano.
O diagnóstico do L/LTA baseia-se em vários aspectos15: 1) Quadro clínico e laboratorial; 2) Morfologia atípica de linfócitos; 3) Imunofenotipagem: CD4+, CD8-, CD25+; 4) Achados histopatológicos de linfoma não-Hodgkin; 5) Detecção de anticorpo anti HTLV-I; 6) Integração monoclonal do HTLV-I proviral no DNA de células neoplásicas.
Nos últimos anos, vários foram os critérios estabelecidos para diagnóstico de L/LTA, sendo que os mais utilizados estão representados nas tabelas 1 e 2.


DISTRIBUIÇÃO MUNDIAL E NO BRASIL
Existem evidências, porém de fundo controverso, que o HTLV-I/II originou-se na África e foi levado ao Caribe através do tráfico de escravos, e para o Japão, durante os séculos XVI e XVII, pela tripulação de navios portugueses. Outros relatos sugerem que o HTLV-I/II já estava presente em indivíduos vivendo no Japão desde a pré-história22-25.
A primeira área endêmica a ser reconhecida foi o Japão, e é deste país que provêm o maior volume de dados sobre aspectos epidemiológicos e clínicos associados à presença do HTLV-I/II.
Epidemiologicamente a infecção pelo HTLV-I/II caracteriza-se por agrupamentos ("cluster") e esta tendência foi inicialmente documentada no sudeste do Japão nas regiões de Kyushu e Shikoku, ilhas de Ryukiju, incluindo Okinawa e também demonstrada na região norte, em Hokkaido, onde a taxa de soroprevalência chega a 45%24,27,28,29,30. Estudos realizados em outros países da Ásia comprovaram a existência de indivíduos soropositivos isolados, com ligações ancestrais com o Japão.
A infecção pelo HTLV-I/II ocorre no mundo inteiro com distribuição que varia de acordo com a localização geográfica, fatores étnicos e raciais ou com grupos de risco pertencentes a subpopulações26.
O Caribe é a maior zona endêmica de infecção pelo HTLV-I. Nesta área a soroprevalência chega a 5% da população geral na Jamaica e Panamá31, e 3% na região de Trinidad e Tobago32. Nos Estados Unidos, estudo realizado em 4,5 milhões de unidades de sangue doadas revelou soroprevalência de 0,016%33, e em outro, analisando-se 400.000 U de sangue, a soropositividade foi de 0,025%. Quando comparados a doadores soronegativos, indivíduos HTLV-I/II soropositivos mais freqüentemente eram mulheres, pessoas mais idosas, descendentes do Caribe, relatavam história pregressa de cirurgias, receberam transfusão de sangue, mantiveram contato sexual com indivíduos originários de áreas endêmicas para HTLV-I/II, e nenhum deles se auto-excluiu do grupo de risco34.
Na Europa, a infecção pelo HTLV-I/II aparenta ser rara e restrita a determinados grupos, como imigrantes de áreas endêmicas, hemofílicos, homossexuais e bissexuais masculinos e usuários de drogas injetáveis35,36. Estudos levados a efeito na Venezuela determinaram soroprevalência de 6,9 % na população geral, disseminada pelas diferentes regiões do país, tanto naquela próxima ao Caribe quanto a compreendida na região Andina e do Amazonas37. Na Colômbia a soroprevalência é de 4,3% para indivíduos que vivem na orla marítima, e 0,6% para os da região montanhosa38. Estudo realizado em 954 doadores em Santiago do Chile, 7 (0,73%) foram soropositivos39.
Estudos soroepidemiológicos e a descrição de doenças relacionadas ao HTLV-I sugerem distribuição endêmica em algumas regiões da América do Sul. Finalmente, no Brasil, alguns dados demonstram que a soroprevalência é alta, variando de 0,47 a 1,8% dependendo do estado brasileiro e tamanho da amostra estudada. Em levantamento realizado em algumas capitais brasileiras, utilizando-se metodologia única para coleta, estocagem, transporte e teste das amostras para HTLV-I/II (ELISA e Western blot), detectou-se a seguinte soropositividade: Manaus (1.200 amostras), 0,33%; Salvador (1.040 amostras), 1,35%; Rio de Janeiro (1.200 amostras), 0,33% e Florianópolis (1.200 amostras), 0,08% para uma soropositividade geral de 0,41%40. Entre 809 amostras de sangue de doadores de Belém do Pará, 1,61% foram soropositivas41. Em São Paulo, o HTLV-I/II tem sido demonstrado em 10% dos pacientes com AIDS, em 1% dos portadores assintomáticos do HIV e em 0,3% dos doadores de sangue42,43,44. Um estudo recente realizado em 17.063 doadores de banco de sangue em São Paulo, identificou 30 (0,18%) soropositivos para HTLV-I/II, sendo a prevalência de HTLV-I de 0,13% e de HTLV-II de 0,03%45. Na Fundação Hemominas, em 1.877 doadores de sangue considerados aptos para a doação, encontraram-se seis (0,32%) soropositivos para ELISA e Western Blot46. Estudos de soroprevalência mais recentes, reportados durante o terceiro simpósio do HTLV no Brasil, demonstraram entre 15.318 amostras de sangue de doadores do HEMO-RJ uma soropositividade para HTLV-I/II (ELISA + WB) de 0,43%; entre 46.183 amostras do HEMO-SP uma taxa de 0,47%; entre 10.535 doadores da Santa Casa-SP uma soropositividade de 0,84%; entre 10.535 amostras do HEMO-CE uma soroprevalência de 0,84% e entre os 45.747 doadores do HEMO-PE uma soropositividade de 0,82% para o HTLV-I/II47.
Embora a soroprevalência seja encontrada entre doadores de sangue dos grandes centros urbanos, a generalização para a população como um todo deve ser feita com restrições, sendo no entanto seguro afirmar que o HTLV-I/II está presente em todas as regiões do Brasil. A soroprevalência média encontrada entre doadores aptos à doação no país é cerca de 20 a 100 vezes maior do que nos Estados Unidos e Europa. Os dados disponíveis até o presente indicam que o Brasil possui o maior número absoluto de indivíduos soropositivos para HTLV-I/II entre os países ocidentais, ou seja, aproximadamente 615.000 pessoas para uma população de cerca de 150.000.000 de habitantes. Deve-se ressaltar que, caso no Brasil a soroprevalência entre homens seja menor que entre mulheres, como ocorre no Japão e Caribe, as estimativas resultantes para a população geral, baseadas em dados de doadores de sangue, cuja grande maioria é do sexo masculino, fica subestimada a real soroprevalência46.
Convém ressaltar que, em praticamente todas as áreas estudadas, é aspecto característico da epidemiologia do HTLV-I/II o aumento da soroprevalência com a idade.
As neoplasias de células T no Brasil têm alta soroprevalência para HTLV-I. Pombo de Oveira et al. (1995)48analisaram, prospectivamente, 188 pacientes com neoplasias de células T, sendo 40 portadores de leucemia ou linfoma linfoblástico, cinco de leucemia prolinfocítica, 53 de L/LTA, 54 linfomas cutâneos de células T, 29 linfomas pleomórficos e sete leucemias linfocíticas de grandes células. Dos 53 L/LTA referidos, 48 (90,5%) tiveram ELISA positivo, destes 44 foram submetidos ao teste confirmatório Western Blot (WB) e 42 (95%) eram positivos e 35 ao PCR com positividade para 29 amostras (81%). Apenas dois outros pacientes com síndrome linfoproliferativa T tiveram ELISA positivo, um WB positivo e nenhum PCR positivo. Este estudo revelou que o L/LTA no Brasil apresenta o mesmo quadro de outros países endêmicos, com apenas duas diferenças: idade, os brasileiros são mais jovens que os japoneses, e o grupo étnico, onde 1/3 dos brasileiros são brancos caucaseanos e descendentes de europeus.
Em levantamento atual encontramos relatos de casos L/LTA em diversos estados brasileiros. Pará: dois casos; Pernambuco: nove casos; Bahia: 16 casos, Espírito Santo: três casos; Rio de Janeiro: 35 casos; Paraná: dois casos; Minas Gerais: seis casos; Ceará: dois casos e São Paulo: 14 casos47. Em relação ao estado de São Paulo podemos adicionar 13 casos que foram estudados em nossa instituição e que não estão incluídos neste levantamento49.
TRANSMISSÃO
Atualmente é conhecida a interrelação dos vírus HTLV-I com o L/LTA, bem como a sua soroprevalência em determinados grupos e sua forma de transmissão. É possível que o risco de desenvolvimento de doenças associadas ao HTLV-I possa ser diferente de acordo com o modo de transmissão do vírus, que ocorre através das seguintes vias: a) Transmissão vertical: da mãe para o filho, no período pré-natal ou pós-natal, através do leite materno. Transmissão intra-uterina também é possível, embora estudos conduzidos no Japão não tenham encontrado anticorpos anti HTLV-I/II no sangue do cordão de crianças, filhas de mães soropositivas50. b)Transmissão sexual: primariamente do homem para a mulher51, porém, foi documentado em estudos com casais e grupos de risco promíscuos, transmissão do masculino para o feminino, feminino para o masculino, e masculino para masculino52. c) Transmissão parenteral: através de transfusão de sangue e de agulhas e seringas contaminadas53.

BIOLOGIA DO VÍRUS

Os vírus linfotrópicos de células T humanos são retrovírus da subfamília Oncovirinae, com genoma de ácido ribonucléico (RNA), que infectam células T maduras, geralmente CD3+ e CD4+. O HTLV tem características de vírus lento, e portanto apresenta período de latência prolongado. O tempo decorrente entre a infecção e o surgimento da doença pode ser de muitos anos e apenas de 1 a 5% dos portadores do vírus desenvolvem patologia correlata.
A estrutura da partícula viral é comum aos demais retrovírus com morfologia de partícula tipo-C, e seu genoma tem estrutura similar ao HIV, isto é, com genes 5'-gag-pol-env-3' e elementos regulatórios da expressão viral. Além da organização geral dos retrovírus, o HTLV apresenta duas proteínas adicionais, tax e rex, localizadas em uma região adicional no terminal 3' conhecida como região X. O gene tax codifica uma proteína de 40 kD para o HTLV-I. Esta proteína é responsável pela ativação transcricional do LTR do HTLV-I. As proteínas rex, de 27 e 21 kD para o HTLV-I, são codificadas pela região que parcialmente se sobrepõe à região do gene tax, mas utiliza uma "open reading frame" alternativa. As proteínas rex estão envolvidas na regulação da expressão dos genes do HTLV, tendo portanto papel de regulação postranscricional. As proteínas codificadas pelo tax e rex são essenciais à replicação do HTLV54,55.
As extremidades do vírus são flanqueadas por duas regiões repetidas, chamadas LTR ("Long Terminal Repeats"), que contêm seqüências específicas onde se ligam reguladores celulares, elementos em "cis". O LTR localizado na região 5' possui função de promotor e terminador de transcrição14. São produtos genéticos antigenicamente importantes (proteínas ou glicoproteínas):
gag: p 53- precursor
p 24/26 - core ou capsídeo
p 19- matriz
p 15
p 26, p 28, p 32 (intermediários do GAG)
env: gp 61/68 - precursor
gp 46 - externa
gp 21 - transmembrana
tax: p 40 (ou p 38) - proteína transativadora
p 24/26 - core ou capsídeo
p 19- matriz
p 15
p 26, p 28, p 32 (intermediários do GAG)
env: gp 61/68 - precursor
gp 46 - externa
gp 21 - transmembrana
tax: p 40 (ou p 38) - proteína transativadora
O ciclo da replicação viral ocorre em duas fases, sendo que a primeira depende somente de componentes virais, e a segunda do metabolismo celular. A primeira fase inclui adesão do vírus à membrana da célula hospedeira, entrada do vírus no citoplasma, transcrição reversa do RNA viral em DNA de fita dupla, transferência do DNA viral para o núcleo, e integração do DNA no genoma da célula hospedeira na forma de provírus. Estas etapas são executadas pelas proteínas contidas no virion infectante. A segunda fase consiste da síntese e processamento do genoma (mRNAs) e de proteínas virais, utilizando sistemas da célula hospedeira e algumas ocasiões utilizando produtos específicos de genes virais55. A montagem do vírus procede com a encapsulação do genoma pelas proteínas codificadas pelos genes gag e gag-pol, processamento dos produtos, associação do nucleocapsídeo com a membrana da célula, e liberação da nova partícula viral por brotamento. Os dois tipos de HTLV, HTLV-I e HTLV-II, apresentam homologia em 65% na seqüência de nucleotídeos e um alto grau de homologia na seqüência de aminoácidos57,58,59.
A história natural da infecção pelo HTLV-I/II não está completamente elucidada, principalmente porque o tempo decorrido entre a exposição/ infecção e o início de sintomatologia é muito longo. No Japão, o risco acumulado durante toda a vida, para desenvolvimento de L/LTA, naqueles que se infectaram na infância, foi estimado em aproximadamente 2,0%60,61. No Brasil, não temos nenhum estudo deste risco. É possível que exista alguma correlação entre a chance de desenvolvimento de doenças associadas ao HTLV-I e o modo de transmissão do vírus.
DETECÇÃO DO VÍRUS
Testes Sorológicos
Os testes sorológicos para diagnóstico da infecção pelo HTLV-I/II utilizam-se da demonstração de anticorpos contra antígenos no soro do indivíduo. Os antígenos do HTLV geralmente não apresentam reação cruzada com antígenos do HIV, e apesar da similaridade entre HTLV-I e II existem testes que contêm alguns antígenos diferentes que permitem distinguí-los.
Elisa
Este teste é usado para detectar o anticorpo numa amostra de soro ou plasma, através de enzima que atua como marcador.
As reações de ELISA utilizam como antígeno o lisado viral e proteínas virais obtidas por tecnologia recombinante ou por síntese de peptídeos. Neste teste pode ocorrer reação cruzada com anticorpos contra HTLV-I e HTLV-II, mas não contra o HIV. A sensibilidade da reação de ELISA para detectar anticorpos contra o HTLV-I varia de 97,3 a 100%, estando a especificidade entre 99,8 e 99,9%. A limitação da técnica de ELISA está situada principalmente na fase inicial de soroconversão, onde ocorre nível baixo de anticorpos.
Hemoaglutinação
As reações de aglutinação utilizam partículas de gelatina ou látex que são sensibilizadas com vírus inativado. Como toda prova de aglutinação, basea-se da no princípio de que as partículas sensibilizadas se aglutinam na presença de anticorpos anti-HTLV presentes no soro ou no plasma do indivíduo. Pode ser utilizada como método de triagem, principalmente em estudos epidemiológicos, valendo salientar a inespecificidade do método.
Western Blot
É ensaio qualitativo "in vitro" para detecção e identificação de anticorpo presente no soro ou plasma através da separação eletroforética de antígeno viral associado a anticorpo específico. O critério de positividade requer reatividade para p19 ou p24 e também para o antígeno do envelope viral (gp46 ou gp68). Reações inespecíficas em indivíduos não infectados podem ocorrer particularmente com reatividade para p19 e rgp21. A reatividade para rpg46 é muito específica para HTLV-I nos indivíduos com perfil de soroconversão. Neste sentido, esta inespecificidade será excluída através da análise molecular das diversas frações virais.
Radioimunoprecipitação (RIPA)
Entre as reações confirmatórias mais confiáveis encontra-se a RIPA, que permite identificar anticorpos contra proteínas de alto peso molecular, especialmente glicoproteínas frágeis. Nesta técnica incuba-se o vírus purificado e desintegrado, que haja crescido em meio de cultura que contenha aminoácido radioativo, com a amostra a ser testada. Em caso de estarem presentes anticorpos contra as proteínas virais, são formados complexos que são em seguida separados por eletroforese e autoradiografados.
PCR para detecção do HTLV-I
A utilização de técnica enzimática "in vitro" de amplificação genética, a reação em cadeia da polimerase (PCR), facilitou extremamente a detecção de retrovírus oncogênicos humanos62,63. A PCR tem sido usada extensivamente em estudos epidemiológicos para se detectar a presença e fazer a distinção do HTLV-I e II em amplo espectro de portadores e de pacientes com variadas moléstias64.
A PCR baseia-se na amplificação enzimática de ácidos nucléicos, envolvendo a síntese in vitro de milhões de cópias de segmentos específicos de DNA. Usam-se para isso iniciadores ou primers, que são pequenos fragmentos de DNA específicos para a área que se quer amplificar. O funcionamento deles se baseia na complementaridade com fita de DNA e são sempre construídos na direção 5'-3'.
O ciclo de amplificação é constituído de três etapas: desnaturação, hibridização e alongamento. Na etapa de desnaturação, o DNA de fita dupla é aquecido a 95°C por 1 a 5 minutos para separação da fita dupla de DNA em fita única. Na etapa de hibridização a temperatura é reduzida para que os primers presentes na solução se hibridizem especificamente com o DNA desnaturado na posição homóloga. A temperatura na qual os primers se separam do DNA molde é denominada temperatura de dissociação (do inglês, melting temperatur" ou Tm). A temperatura de dissociação depende da concentração de guanidina-citosina na composição do oligonucleotídeo65. Na etapa de alongamento os primers são estendidos pela adição de nucleotídeos complementares ao DNA no terminal 3'. Utiliza-se para a polimerização a taq DNA polimerase, que é enzima altamente resistente ao calor, por ter sido isolada de microorganismo (Thermophilus aguaticus) que vive em altas temperaturas. Tendo em vista todos estes dados, há de se concluir que a descoberta do L/LTA foi de grande projeção para a medicina, virologia e biologia. "Abriu-se uma nova era para a ciência".
REFERÊNCIAS BIBLIOGRÁFICAS:
1. Yodoi J. Takatsuki K. Masuda T. Two cases of T-cell chronic lymphocytic leukemia in Japan. New Engl. J. Med1974; 290: 572-3. [ Links ]
2. Takatsuki K. Uchiyama T. Sagawa K. Yodoi J. Adult T-cell leukemia in Japan. In Seno S, Takaku F, Irino S.Topics in Hematology. Amsterdam, Excerpta Medica, 1977; p. 73-7. [ Links ]
3. Uchiyama T. Yodoi Y. Sagawa K. Takatsuki K. Uchimo H. - Adult T-cell leukemia: clinical and hematological features of 16 cases. Blood 1977; 50: 481-92. [ Links ]
4. Poiesz BJ. Ruscetti FW. Gazdar AF et al. Detection and isolation of type-C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc. Natl. Acad. Sci. 1980; 77: 7.415-9. [ Links ]
5. Miyoshi I. Kubonishi I. Sumida M et al. Characteristics of a leukemia T-cell line derived from adult T-cell leukemia . Jpn. J. Clin. Oncol.1979; 9: 485-94. [ Links ]
6. Hinuma Y. Nagata K. Hanaoka M et al. Adult T-cell leukemia: antigen in an adult T-cell leukemia cell line and detection of antibodies to the antigen in human sera. Proc. Natl. Acad. Sci. 1981; 78: 6.476-80. [ Links ]
7. Seiki M. Hattori S. Hirayama Y. Yoshida M. Human adult T-cell leukemia virus; complete nucleotide sequence of the provirus genome integrated in leukemia cell DNA. Proc. Natl. Acad. Sci. 1983; 80: 3.618-22. [ Links ]
8. Kitagawa T. Taguchi H. Miyoshi T. Tadokoro M. Antibodies to HTLV-I in japanese imigrants in Brasil. JAMA 1986; 256: 2.342. [Letter] [ Links ]
9. Pombo de Oliveira MS. Matutes E. Famadas LC et al. Adult T-cell leukaemia/lymphoma in Brazil and its relation to HTLV-I. Lancet 1990; 336: 987-90. [ Links ]
10. Takatsuki K. Yamaguchi K. Watanabe T et al. Adult T-cell leukemia and HTLV-I related diseases. In Takatsuki k, Hinuma Y, Yoshida M. Advances in adult T-cell leukemia and HTLV-I research. Tokyo, Japanese Scientific Societies Press, 1992; p. 1-15. [ Links ]
11. Kiyokawa T. Yamaguchi. Takashi T. Watanabe T. M. T. Lee SY. Takatsuki K. Hypercalcemia and osteoclast proliferation in adult T-cell leukemia. Cancer 1987; 59: 1.187-91. [ Links ]
12. Niitsu Y. Urushizaki Y. Koshida Y et al. Expression of TGF-b gene in adult T-cell leukemia. Blood 1988 71: 263-6. [ Links ]
13. Watanabe T. Yamaguchi K. Takatsuki K. Osame M. Yoshida M. Constitutive expression of parathyroid hormone related protein gene in human T-cell leukemia virus type I carriers and adult T-cell leukemia patients which can be transcribed by HTLV-I tax gene. J. Exp. Med. 1990; 172: 759-65. [ Links ]
14. Watanabe S. Mukai K. Shimoyama M. Adult T-cell leukemia/lymphoma. In Daniel M. & Knowlers, M.D.Neoplastic Hematopathology. Baltimore, William & Wilkins, 1992; p. 1281-94. [ Links ]
15. Takatsuki K. Matsuoka M. Yamaguchi K. ATL and HTLV-I related diseases. In Takatsuki K. Adult T-cell Leukemia. New York, Oxford medical publications, 1994; p. 1-27. [ Links ]
16. Sanada I. Tanaka R. Kumagai E et al. Chromossomal aberrations in adult T-cell leukemia: relationship to the clinical severity. Blood 1985; 65: 649-54. [ Links ]
17. Kamada N. Sakurai M. Miyamoto K et al. Chromossome Abnormalities in adult T-cell leukemia/lymphoma: a karyotype review committee report. Cancer Res 1992; 52: 1.481-93. [ Links ]
18. Yamaguchi K. Kiyokawa T. Futami G. Ishii T. Takatsuki, K. Pathogenesis of adult T-cell leukemia from clinical patologics features. In: Blattner W. Human Retrovirogy: HTLV. New York, Raven Press, 1990; p. 163-71. [ Links ]
19. Shimoyama, M.; and members of the lymphoma study group. - Diagnostic criteria and classification of clinical subtypes of adult T-cell leukaemia/lymphoma. Br. J. Haematol 1991; 79: 428-39. [ Links ]
20. Matutes E. & Catovsky D. Adult T-cell leukaemia lymphoma. In Whittater JA. Leukaemia, 2th ed. Oxford, Blackwell Scientific Publications, 1992; p. 416-33. [ Links ]
21. Levine PH. Cleghorn F. Manns A et al. Adult T-cell leukemia/lymphoma: A working point-score classification for epidemiologic studies. Int. J. Cancer 1994; 59: 419-93. [ Links ]
22. Fleming AF. HTLV from Africa to Japan. Lancet 1984; 2: 334-5. [ Links ]
23. Gallo RC. Sliski A. Wong-Staal F. Origin of human T-cell leukemia-lymphoma virus. Lancet 1983; 2: 962-3. [ Links ]
24. Ishida T. Yamamoto K. Omoto K et al. Prevalence of a human retrovirus in native japanese: evidence for a possible ancient origin. J. Infect 1985; 11: 153-7. [ Links ]
25. Yanagihara R. Jenkis CL. Alexander SS. Mora CA. Garruto RM. Human T lymphotropic virus type I infection in Papua New Guinea: high prevalence among the Haghai confirmed by Western analysis. J. Infec. Dis. 1990; 162: 649-54. [ Links ]
26. Blattner WA. Retroviruses. In Evans AS. Viral infections of humans: epidemiology and control. New York, Palenum Medical Book Co, 1989; p. 545-92. [ Links ]
27. Blattner WA. Blayney DW. Robert-Guroff M et al. Epidemiology of human T-cell leukemia/lymphoma virus. J. Infect. Dis. 1983; 147: 406-16. [ Links ]
28. Hinumay. Komoda H. Chosa T et al. Antibodies to adult T-cell leukemia- virus associated antigen (ATLA) in sera from patients with ATL and controls in Japan: a nation-wide seroepidemiologic study. Int. J. Cancer 1982; 29: 631-5. [ Links ]
29. Sarim, S.G.; Fang, C.; Williams A. Retroviral infections transmitted by blood transfusion. Yale J. Biol. Med1990; 63: 353-60. [ Links ]
30. Tokudome S. Tokunaga O. Shimamoto Y et al. Incidence of adult T-cell leukemia/lymphoma among human T-lymphotropic virus type I carriers in Saga. Jpn. Cancer Res 1989; 49: 226-9. [ Links ]
31. Murphy EL. Gibbs WN. Figueroa JP et al. Human immunodeficiency virus and human T-lymphotropic virus type I infection among homosexual men in Kingston. Jamaica. J. Acquir. Immunodefic. Syndr. 1988; 1:143-9. [ Links ]
32. Reeves WC. Saxinger C. Brenes MM et al. Human T-cell ymphotropic virus type I (HTLV-I) seroepidemiology and risk factors in metropolitan Panamá. Am. J. Epidemiol. 1988; 127: 532-9. [ Links ]
33. Fang CT. Willians E. Sandler SG et al. Seroprevalence and geographical determinants of anti-HTLV among blood donors in the United States. Proceedings of the 3rd Annual Retrovirology Meeting, Hawaii, 1990. [ Links ]
34. Bianco C. Kessler D. Valinsk JE. Serologic and demographic protile of blood donors positive for HTLV-I/II. Proceedings of the 3rd Anual Retrovirology Meeting, Hawaii, 1990. [ Links ]
35. Lee HH. Weiss SH. Brown LS et al. Patterns of HIV-1 and HTLV-I/II intravenous drug abusers from the middle Atlantic and Central regions of the USA. J. Infect. Dis. 1990; 162: 347-52. [ Links ]
36. Levine PH. Jacobson S. Elliott R et al. HTLV-II infection in Florida Indians. AIDS Res. Hum. Retroviruses 1993; 9:123-7. [ Links ]
37. Merino F. Robert-Guroff M. Clark J et al. Natural antibodies to human T-cell leukemia/lymphoma virus in healthy Venezuelan population. Int. J. Cancer 1984; 34: 501-6. [ Links ]
38. Maloney EM. Ramirez H. Levine A. Blatter WA. A survey of the human T-cell lymphotropic virus type I (HTLV-I) in South-Western Colombia. Int. J. Cancer. 1989; 44: 419-23. [ Links ]
39. Vasquez P. Sanchez G. Volante C et al. Human T-lymphotropic virus type I: new risk for Chilean population.Blood 1991; 78: 850. [ Links ]
40. Galvão B. Proietti F. Rodrigues L et al. HTLV-I/II differential geographic distribution in Brazil. In: Conference on AIDS, 10, Brasil, 1994. [ Links ]
41. Saraiva JCP. Saraiva ASL. Couroucé FCAM. Detecção de anticorpos anti-HTLV-I em doadores de sangue de Belém do Pará. In: Congresso Nacional do Colégio Brasileiro de Hematologia, 12, Fortaleza, 1989. [ Links ]
42. Cortes E. Detels R. Aboulafia D. Li XL et al. HIV-1, HIV-2 and HTLV-I infection in high-risk groups in Brazil. N. Engl. J. Med. 1989; 320: 953-8. [ Links ]
43. Casseb JSR. Araújo AC de. Mirim L. Duarte AJS. Soroprevalência de anticorpos anti HTLV-I/II em indivíduos assintomáticos infectados pelo HIV em São Paulo. Rev. Soc. Brasil Med. Trop.1994; 27: 29. (Abstract) [ Links ]
44. Alquezar AS. Bassit L. Barreto CC et al. Prevalence of anti-HTLV-I antibodies in blood donors, São Paulo, Brazil. In: Encontro Nacional de Virologia, 6, São Lourenço, 1992. Anais. Belo Horizonte, 1992. p. 208. [ Links ]
45. Ferreira OC. Vaz MB. Carvalho C et al. Human T-lymphtropic virus type I and type II infections and correlation with risk factors in blood donors from São Paulo, Brazil. Transfusion 1995; 35: 258-63. [ Links ]
46. Proietti ABFC. HTLV-I/HTLV-II. In: Proietti FA. & Proietti ABFCFA Epidemiologia do HTLV-I/II no Brasil e no Mundo. Belo Horizonte, 1994; p. 22-34. [ Links ]
47. Pombo de Oliveira MS. Hamerschlak N. Chiattone C et al. HTLV-I infection and adult T-cell leukemia in Brazil: an overview. São Paulo Medical Journal. 1996; 114: 1177-85. [ Links ]
48. Pombo de Oliveira MS. Matutes E. Schulz TF et al. T-cell Malignancies in Brazil. Clinico-Pathological and Molecular Studies of HTLV-I positive and- negative cases. Int. J. Cancer.1995; 60: 823-7. [ Links ]
49. Borducchi DMM. Oliveira JSR. Yamamoto M. et al. HTLV-I. Associated Adult Tcell Leukaemia Lymptoma (ATLL): Clinical and Laboratorial Features in Brasil. Cancer Research. 1997; 28: 1-6 [ Links ]
50. Fujino T. Fujiyoshi T. Yashiki S et al. HTLV-I transmission from mother to fetus via placenta. Lancet 1992; 340: 1157. [ Links ]
51. Murphy EL. Figueroa JP. Gibbs WN et al. Sexual transmission of human T-lymphotropic virus type I (HTLV-I).Ann. Intern. Med. 1989; 111: 555-60. [ Links ]
52. Bartholomew C. Blattner W. Cleghorn F Progression to AIDS in homosexual men co-infected with HIV and HTLV-I in Trinidad. Lancet 1987; 2: 1469. [Letter] [ Links ]
53. Okochi K. Sato H. Hinuma Y. A retrospective study on transmission of adult T-cell leukemia virus by blood transfusion: seroconversion in recipients. Vox Sang 1984; 46: 245-53. [ Links ]
54. Felber BK. Paskalis H. Kleinman-Ewing C. Wong-Stal F. Pavlakis GN. The pX protein of HTLV-I is a transcriptional activatior of its long termial repeats. Science 1985; 229: 675-9. [ Links ]
55. Shah A. Wachsman W. Souza L et al. Comparison of the trans-activation properties of the HTLV-I and HTLV-II x proteins. Mol Cell Biol 1986; 6: 3626-31. [ Links ]
56. Dixon AC. Dixon PS. Nakamura, JM. Infection with human T lymphotropic virus type I: a review for clinicians.West J. Med. 1989; 151: 632-7. [ Links ]
57. Allan JS. Coligan JE. Lee TH et al. Immunogenic nature of a pol gene product of HTLV-II/LAV. Blood 1987; 69: 331-3. [ Links ]
58. Coffin JM. - Retroviridae and their replication. In FIELDS BN. & KINPE DM. Virology, 2th ed. New York, Raven Press, 1990. p. 1.437-500. [ Links ]
59. Hanada S. Koyanagi Y. Yamamoto N. Infection of HTLV-II/LAV in HTLV-I-carrying cells. MT-2 and MT-4 and application in plaque assay. Science 1985; 229: 563. [ Links ]
60. Kondo T. Nonaka H. Miyamoto N et al. Incidence of adult T-cell leukemia-lymphoma and its familial clustering.Int. J. Cancer 1985; 35: 749-51. [ Links ]
61. Kondo Y. Komo H. Nonaka H et al. Risk of adult T-cell leukemia/lymphoma in HTLV-I carriers. Lancet 1987; 2: 159. [ Links ]
62. Abbott M. Poiez J. Kwok B. Byrne B. Ehrlich G. A comparision of methods for the detection and quantification of the polymerase chain reaction. J. Infect. Dis. 1988; 158: 1.158-69. [ Links ]
63. Kwok, S.; Ehrlich, G.; Poiez, B.; Kalish, R.; Sninsky, J.J. - Enzymatic amplification of HTLV-I viral sequences from peripheral blood mononuclear cells and infected tissues. Blood 1988; 72: 1117-23. [ Links ]
64. Ohara Y. Iwasaki Y. Izumo S. Kobayashi I. Yoshioka A. Search for human T-cell leukemia virus type I (HTLV-I) proviral sequences by polymerase chain reaction in the central nervous system tissue of HTLV-I associated myelopathy. Arch. Virol 1992 ; 124: 31-43. [ Links ]
65. Saiki, R.K. - The design and optimization of the PCR. In Ehrlich H.A. PCR technology principes and applications for DNA amplification. New York, M Stockton Press, 1989; p. 7-16. [ Links ]
Nenhum comentário:
Postar um comentário